
Отсутствие функциональной микроциркуляции, в значительной степени, препятствует успешному клиническому применению многих методик костной пластики. По настоящее время, костные трансплантаты зависимы от васкуляризации, что ставит под угрозу интеграцию трансплантата и часто ведет к его отторжению. Поэтому, разработка стратегий, которые могли бы способствовать установлению микроциркуляции, стала одной из основных задач тканевой инженерии.
Эта статья посвящена роли и важности развития сосудистой сети при костной пластике и тому, какую важную роль в этом процессе играют лейкоциты.
Одним из наиболее широко проверенных методов тканевой инженерии для восстановления и регенерации костных дефектов является создание трехмерного (3D) каркаса. Однако недостаток функциональной микроциркуляции, связанной с кровоснабжением области графта, является главной причиной неудач при костной пластике и в настоящее время считается важнейшей проблемой тканевой инженерии.
Кость является метаболически активной тканью, снабжаемой через внутрикостную сосудистую систему, образованную остеоцитами, которые расположены на расстоянии не 0,1 – 0,2 мм от ближайшего капилляра. При костной пластике, формирование новых кровеносных сосудов из уже существующих, или ангиогенез, происходит самопроизвольно. Эти сосудистые реакции - это ответ на воспаление, которое является неотъемлемой частью процесса заживления, и которое стимулирует организм в ответ на ишемию и повреждение в ходе хирургической операции. Однако медленные темпы проникновения кровеносных сосудов в костный каркас (< 0,1 мм) делают этот процесс недостаточным для успешной васкуляризации костного трансплантата.
Еще одна проблема, связанная с недостаточной васкуляризацией - это удаление продуктов распада. В отсутствие функциональной микроциркуляции, способность окружающих тканей удалить продукты распада, образуемые из материала костного графта, очень низкая. В результате, происходит огромный выброс побочных продуктов, которые накапливаются локально и вызывают воспалительные реакции.
Образование связи между сосудистой системой области графта и костного графта – это не быстрый процесс и может занять до восьми дней, что может привести к ишемии и неблагоприятной среде. В результате этого, спонтанная неоваскуляризация от области графта после имплантации не является достаточной для успешной интеграции костного графта. В этой связи возникает необходимость в новой стратегии для того, чтобы ускорить процесс неоваскуляризации.
Сосудистая сеть играет важную роль в формирования костной ткани за счет образования факторов роста, которые контролируют набор, рост, дифференциацию, функционирование и выживание различных клеток, включая формирующие кость остеобласты и резорбирующие кость остеокласты. Эти биологически активные факторы, секретируются эндотелиальными клетками, т.е. теми клетками, которые образуют внутреннюю выстилку кровеносных сосудов. Поэтому, ангиогенез не только предшествует остеогенезу, но он просто необходим для процесса остеогенеза. Это осуществляется комбинацией факторов, включая достаточное содержание кислорода, питательные вещества и факторы роста.
Вторгающаяся сосудистая сеть, таким образом, служит одновременно как резервуар, так и канал для набора необходимых типов клеток, участвующих в процессе резорбции и отложения кости, регулирует функциональную деятельность этих клеток, и обеспечивает ключевые сигналы для морфогенеза кости.
Когда кость повреждается, то не только скелетная целостность в месте трансплантата нарушается, но и также нарушается внутрикостная сосудистая сеть. Сначала образуется гематома, затем наступает гипоксия в месте костного графта из-за нарушения кислородного питания.
Гипоксия является важным физиологическим сигналом в процессе восстановления кости потому, что она регулирует выработку ключевых модуляторов остеобластами, что вызывает пролиферацию эндотелиальных клеток, прямую клеточную дифференциацию, и стимулирует эндотелиальные клетки секретировать остеогенные факторы роста.
Воспалительная реакция и гипоксия окружающей среды связаны с выбросом нескольких факторов роста и цитокинов, инициирующие миграцию эндотелиальных клеток и формирование новых капилляров. На самом деле, реконструкция внутрикостной циркуляции является одним из первых событий в процессе восстановления кости.
Учитывая сложную взаимосвязь между ангиогенезом и остеогенезом, не удивительно, что связь между остеобластами и эндотелиальными клетками является одним из наиболее важных клеточных взаимодействий, которые организуют формирование кости.
Одним из наиболее изученных факторов роста является эндотелиальный фактор роста сосудов (VEGF) - мощный и специфичный ангиогенный цитокин, образуемый на месте перелома или костного трансплантата многочисленными типами клеток, в том числе остеобластами. Помимо того, что VEGF является фактором роста для клеток эндотелия, он также вызывает повышение сосудистой проницаемости и миграцию моноцитов через слои эндотелия. Другой ангиогенный фактор роста, фактор роста фибробластов, также продуцируется остеобластами.
Взаимосвязь между эндотелиальными клетками и остеобластами является двунаправленной. Эндотелиальные клетки также секретируют многочисленные регуляторные молекулы, оказывающие огромное влияние на дифференциацию и деятельность костеобразующих клеток. Костный морфогенетический белок – 2 (BMP-2) и эндотелин -1 (ET-1) являются двумя факторами роста, продуцируемыми эндотелиальными клетками, которые содействуют пролиферации и дифференциации остеобластов. Кроме того, тромбоцитарный фактор роста BB (PDGF-BB), выпускаемый на месте перелома или костного графта несколькими типами клеток, включая эндотелиальные клетки, оказывает митогенный и хемотаксический эффект на остеобласты. Остеогенные факторы роста, продуцируемые эндотелиальными клетками (BMP-2, PDGF-BB) и остеобластами (инсулиноподобный фактор роста, IGF, и трансформирующий фактор роста, TGF) также оказывают ангиогенный эффект, стимулируя выражение VEGF в mRA остеобластов.
Внешние факторы, такие как гипоксия микросреды в месте перелома или костного трансплантата, стимулируют выражение различных цитокинов воспалительными клетками, эндотелиальными клетками, остеобластами, и фибробластами. Эндотелиальные клетки и остеобласты реагируют на гипоксию повышением регуляции выражения многочисленных остеогенных факторов (ET-1, PDGF-BB, BMP-2, IGF-II, и TGF-/S1) и фактора роста сосудов, VEGF.
APRF (аутогенный богатый тромбоцитами фибрин) был предложен в целях ускорения образования функциональной сосудистой сети в костных графтах.
В течение последних нескольких лет концептуальный сдвиг произошел в развитии костной инженерии - от графтов, которые поддерживали костеобразующие клетки, до графтов, которые содержат сосудистую сеть. Фибрино-комбинированный каркас был разработан с целью содействия миграции эндотелиальных клеток и создания сосудистой сети.
Фибрин обеспечивает хемотаксические и гаптотаксические сигналы мигрирующим эндотелиальным клеткам, как физического, так и химического обозначения для усиления их подвижности. В последние годы наблюдается сдвиг в парадигме костной инженерии. Основную роль всегда играли остеобласты и остеокондуктивные и/или индуктивные свойства биоматериалов, а костная сосудистая сеть, как правило, была сведена на нет. В последнее время, этот сценарий меняется, поскольку стало ясно, что успешный клинический итог имплантированной клеточной конструкции зависит от создания функциональной сосудистой сети. Кроме того, появилось большое количество доказательств, подчеркивающих решающую роль внутрикостной сосудистой сети на развитие, восстановление и ремоделирование кости. Сложная взаимосвязь между ангиогенезом и остеогенезом была обнародована и взаимосвязь между остеобластами и эндотелиальными клетками была установлена, как одна из наиболее важных клеточных взаимодействий, которые управляют костными процессами.
APRF (аутогенный богатый тромбоцитами фибрин) принадлежит к новому поколению тромбоцитарных концентратов, без биохимической обработки крови. Действительно, биологическая активность молекулы фибрина уже сама по себе достаточна для объяснения значительной заживляющей способности APRF. А медленный режим полимеризации обеспечивает APRF мембранам особенно благоприятную физиологическую архитектуру для поддержки процесса заживления.
Биохимический анализ состава APRF указывает, что этот биоматериал состоит из тесной организации цитокинов, гликановых цепей, и структурных гликопротеинов, погруженных в медленно полимеризованную сеть фибрина. Хорошо известно, что эти биохимические компоненты имеют синергический эффект на процессы заживления. Например, фибронектин, являющийся гидом для клеточной пролиферации и миграции, усиливает стимулирующие эффекты PDGF-BB. Эти предварительные данные таким образом означают, что APRF является не только тромбоцитарным гелем, но и полностью пригодным заживляющим концентратом.
APRF - это не только тромбоцитарный концентрат, но также и иммунный узел, способный стимулировать защитные механизмы. Вероятнее всего, что значительная воспалительная регуляция, отмечаемая в хирургических местах, где использовался PRF, является последствием эффектов от цитокинов, находящихся в сети фибрина и освобожденных в процессе ремоделирования.
APRF можно рассматривать как заживляющий биоматериал. Он имеет все необходимые параметры, обеспечивающие оптимальное заживление. Сюда входят фибриновая основа, полимеризованная в тетрамолекулярную структуру, включение тромбоцитов, лейкоцитов и цитокинов, и присутствие циркулирующих стволовых клеток.
Цитокины, находящиеся в APRF, постепенно высвобождаются и способны ускорить клеточные события. Структура фибриновой сети является ключевым элементом улучшенного APRF процесса заживления.
APRF следует рассматривать как фибриновый биоматериал. Его молекулярная структура с низкой концентрацией тромбина является оптимальной основой для миграции эндотелиальных клеток и фибробластов. Она обеспечивает быстрый ангиогенез и упрощенное ремоделирование фибрина в более устойчивую соединительную ткань. Поэтому эти APRF мембраны могут быть использоваться для всех типов заживления - как поверхностных кожных, так и слизистых оболочек.
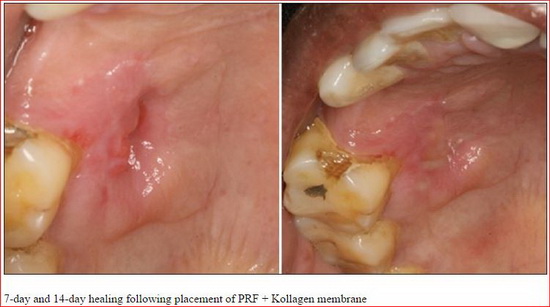
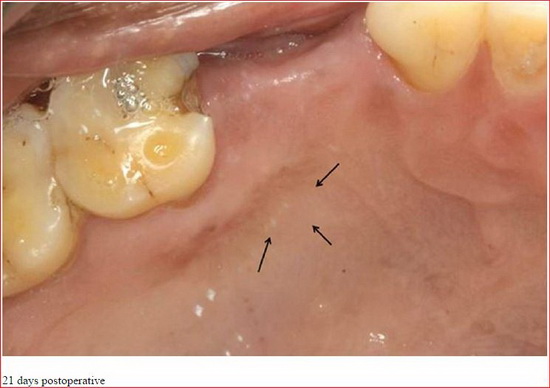
APRF не только простая фибриновая мембрана. Он также представляет собой основу, содержащую все молекулярные и клеточные элементы, обеспечивающие оптимальное заживления. Современные исследования все чаще демонстрируют центральной роли, которую играют макрофаги/моноциты в регулировании развития и заживления кости.
APRF является инновационным инструментом в регенеративной медицине и его использование в различных терапевтических ситуациях, вызвало жаркие споры. К сожалению, в области научных исследований фокус был в основном сосредоточен на тромбоцитарных факторах роста, но не на архитектуре фибринового сгустка и лейкоцитарном содержании этого продукта. Содержание лейкоцитов в APRF оказывает большое воздействие на биологии окружающих тканей, не только из-за их иммунной и антибактериального свойства, но также и потому, что они являются активаторами процесса заживления ран и местных факторов регулирования роста костных клеток и клеток мягких тканей. Различные виды лейкоцитов (в частности, моноциты), содержат большое разнообразие факторов роста и обладают свойствами, которые используются клетками для защиты раны против инфекций и регулирования процесса заживления.
Наконец, реализация лейкоцитарного воздействия в области местного регулирования деятельности клеток и их дальнейшей специализации (дифференциации), является ключевой функцией APRF. Еще одно важное свойство - это медленное выделение в больших количествах основных факторов роста (трансформирующий фактор роста b-1 (TGFp-1), тромбоцитарный фактор роста AB, PDGF-Ab, эндотелиальный фактор роста сосудов (VEGF) и важный коагуляционный гликопротеин тромбоспондин -1 (TSP-1) AFRF течение 7 дней.
Таким образом, свойства этого естественного фибринового биоматериала открывают широкие возможности для процесса заживления. Вот почему этот биоматериал может считаться физиологическим концентратом.

Статья предоставлена компанией "Инно Имплант РУ", представляющей на российском рынке не имеющие мировых аналогов центрифуги для создания APRF. Этот аппарат предназначен для безопасной и быстрой подготовки аутогенного, богатого тромбоцитами и всеми формами лейкоцитов фибринового сгустка из небольшого количества крови, взятой у пациента.
8 (800) 707 303 7
info@inno-implant.ru
inno-implant.ru