
Дмитриева Е.Ф.,
врач-стоматолог, ООО «ТалисманДент М», г. Челябинск
Нуриева Н.С., д.м.н.,
доцент кафедры ортопедической стоматологии ЮУГМУ
Во всем мире рак головы и шеи составляет около 10% всех злокачественных новообразований [1]. Лечение злокачественных новообразований головы и шеи требует мультидисциплинарного подхода, сотрудничества врачей различных специальностей: хирурга-онколога, радиолога, химиотерапевта, рентгенолога, эндоскописта, стоматолога, патоморфолога, цитолога, а также врачей некоторых других специальностей, каждый из которых участвует в установлении диагноза, оценки степени распространения опухоли, выработке тактики лечения и его проведении [2]. Выбор стратегии и лечения в основном осуществляется между хирургическим лечением, лучевой терапией и комбинированными методами.
Лучевая терапия – метод лечения с использованием ионизирующего излучения. Среди различных методов лечения в клинической онкологии лучевая терапия занимает одно из ведущих мест. По данным ВОЗ, 70-75% онкологических больных нуждаются в проведении лучевой терапии. Облучение может быть радикальным, паллиативным или используется в комбинации с операцией. К преимуществам лучевой терапии следует отнести ее хорошую переносимость, возможность достижения в ранних стадиях некоторых опухолей стойкого излечения с сохранением функции пораженного органа. Применение лучевого лечения в качестве паллиативной, самостоятельной терапии в неоперабельных случаях является самым эффективным среди других лечебных мероприятий.
В лучевой терапии органов головы и шеи в самостоятельном плане для получения радикального или паллиативного эффекта широко применяется подобранный ритм ежедневного облучения по 2 г (5 раз в неделю; за неделю – 10 г). Суммарная очаговая доза при этом составляет (при средней радиочувствительности опухоли) 60-70 г. Лучевая терапия проводится по расщепленной программе: первый курс – до суммарной очаговой дозы 30 г, затем следует перерыв в лечении на 2-3 нед. Второй курс проводится также разовой очаговой дозой 2 г до суммарной очаговой дозы 40 г (общая суммарная доза – 70 г) [3].
Однако проблемой при этом остается довольно высокая частота тяжелых посттерапевтических осложнений, существенно снижающих возможности метода лечения. Частым осложнением лучевой терапии является лучевое поражение зубов (рис. 1).
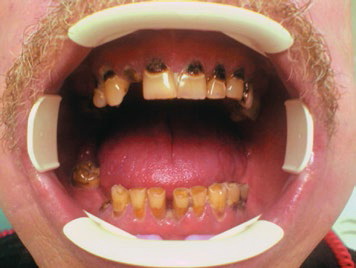
Рис.1. Лучевой некроз зубов после курса лучевой терапии (54 г)
Одним из перспективных направлений в этом плане является использование современных технических достижений, позволяющих снизить объем нежелательно облучаемых нормальных тканей с концентрацией максимальной дозы излучения на уровне опухоли и на этой основе улучшить результаты лечения этого контингента больных [4].
С целью повышения эффективности лучевой терапии обосновано применение режимов гиперфракционированного облучения. По мнению некоторых отечественных и зарубежных исследователей, увеличение разовой очаговой дозы до 2,4-3 г при условии подведения последней за 2-3 фракции в сутки с интервалом между фракциями не менее 4 часов сопровождается повышением эффективности лечения рака носоглотки на 20-30% [5,6]. В исследовании, выполненным S.L. Wolden и соавт., которые провели сравнительный анализ результатов облучения в обычном режиме фракционирования дозы (1,8 г/5 раз в неделю/70 г) и динамического фракционирования, когда в течение 5-й и 6-й недель проводится облучение с использованием ускоренного фракционирования разовой дозой 1,6 г 2 раза в день в сочетании с химиотерапией цисплатином. Отмечено статистически значимое увеличение частоты полной резорбции опухоли, безрецидивной и общей выживаемости [14]. По результатам исследований ряда авторов, ранние лучевые повреждения со стороны слизистой оболочки встречались значительно чаще при гиперфракционировании. Однако число поздних лучевых повреждений было одинаковым [7].
Не меньшее значение уделяется качеству проведения лучевой терапии. Применение особых приспособлений (подголовники, маски из термоплавких пластмасс), фиксирующих определенное положение больного в процессе облучения, индивидуальное дозиметрическое планирование на основе рентгеновской компьютерной томографии и формирование динамически изменяющихся фигурных полей облучения с помощью мультилифтного коллиматора способствуют повышению эффективности лучевой терапии. В сравнении со стандартной программой лучевой терапии применение методики конформного облучения на основе трехплоскостного планирования позволяет создать оптимальное соотношение между дозой излучения, подводимой к опухоли и в окружающих тканях [8].
Лучевые поражения твердых тканей зуба при длительном воздействии на организм малыми дозами зависят от суммарной дозы, облучения, интенсивности облучения и фактора времени. Изменения в тканях зуба проявляются в виде меловых пятен, пигментации, размягчения и некроза эмали и дентина (рис. 2).
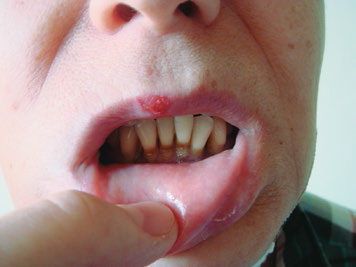
Рис.2. Лучевой кариес после сплит-курса лучевой терапии
Большие дозы облучения могут приводить к некрозу больших участков эмали и дентина в области иммунных зон зубов. Изменения в пульпе проявляются в виде гиалинизации стенок сосудов, вакуольного и жирового перерождения, атрофии и дегенерации одонтобластов и т.д. Комплекс патоморфологических изменений в тканях зуба при этих поражениях во многом напоминает кариес зубов, что дало основание ввести термин лучевой кариес.
Лучевой кариес зуба – (c. dentis radialis) генерализованный кариес зуба, развивающийся как осложнение рентгено- или радиотерапии челюстно-лицевой области; протекает с пигментацией и размягчением поверхностных слоев и образованием глубоких пришеечных полостей.
До настоящего времени не разработано единое мнение по поводу механизма и характера изменений в тканях зуба и полости рта вследствие радиационного излучения.
Иванова Л.А. считает, что возникающие под влиянием ионизирующего излучения распад белковых молекул, нарушения обменных процессов, расстройства кровообращения, гипоксия в совокупности способствуют развитию неблагоприятных условий существования пульпы, и чем дольше они будут иметь место, тем более тяжелыми могут быть последствия как для пульпы, так и для твердых тканей зуба [9]. По мнению Барер Г.М., Иванчиковой Л.А., в основе изменений твердых тканей лежат повреждения белковой матрицы и нарушение химической связи между минеральной и белковой фракциями. Уже в процессе облучения авторы наблюдали в дентине и цементе зубов экспериментальных животных деминерализацию и деструктивные изменения, что можно объяснить особенностями гистологического строения твердых тканей, чрезвычайно низким обменом веществ в них, неспособностью тканей к восстановлению [10].
По данным Окадо Ш., 1979, дальнейшее развитие возникших во время облучения изменений дентина, характеризующиеся продолжающейся деминерализацией, увеличением очагов деструкции, разрушением эмалево-дентинного соединения, появлением лакунарного рассасывания дентина на границе с пульпой объясняется как реакцией последствия, так и влиянием поврежденной пульпы, восстановление которой после облучения является неполным. В разрушении эмалево-дентинного соединения имеет значение различие в интенсивности деминерализации эмали и дентина. Насыщенность минеральными веществами дентина снижается в значительно большей степени, чем эмали, что приводит к дезинтеграции этих тканей.
Иванова Л.А., Боровский Е.В., Сегень И.Т. и Назаров Г.И. указывают, что патологический процесс возникает одновременно во многих зубах, распространяется вокруг шеек и по поверхностям коронок, заканчиваясь, как правило, отломом зуба на уровне десневого края. Авторами обращается внимание на неэффективность пломбирования из-за появления вокруг пломб, а также в ранее неповрежденных участках новых дефектов [9, 11, 12].
Изменения на слизистой оболочке полости рта, на что указывает Щелканогова М.Г. и соавт., 1993, плохая гигиена в комплексе приводят к нарушению самоочищения зубов, на поверхности эмали создается критическая ситуация (pH 4-5 под налетом), благоприятствующая деминерализации облученной эмали. Повышается чувствительность зубов к изменениям температуры, к давлению, к сладкому и кислому, изменяется цвет (до светло- или темно-серого), эмаль теряет блеск, становится ломкой хрупкой; зубы покрыты толстым клейким трудноудаляемым налетом. Появляется кариесогенная микрофлора. Кариес возникает и на сравнительно редко поражаемых участках (в области бугров, на режущих отделах). Наиболее характерен пришеечный кариес передних зубов. Процесс протекает безболезненно, быстро прогрессирует и заканчивается отломом коронок.
Принципы профилактики и лечения отражены в протоколе Dental Disease Section/International Society of Oral Oncology (ISOO) (2010):
1. Применение фторидсодержащих препаратов. Реминерализующая терапия значительно снижает риск развития патологии твердых тканей зубов (Level of Evidence: II, Grade of Recommendation: B), (рис. 3).
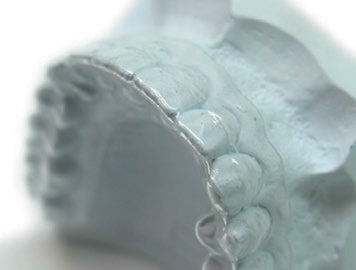
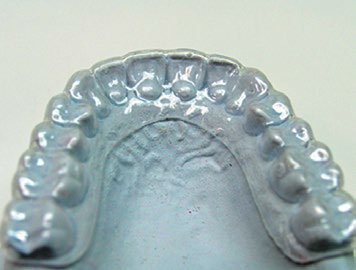
Рис.3. Каппы для реминерализующей терапии
2. Применение полосканий для полости рта с хлоргексидином. Использование этих препаратов улучшает гигиеническое состояние полости рта, а также способствует снижению числа Streptococcus mutans. При назначении хлоргексидин содержащих полосканий необходимо принимать к сведению возможность возникновения таких побочных эффектов как окрашивание зубного камня и изменение вкусовой чувствительности (Level of Evidence: II, Grade of Recommendation: B).
3. Восстановление дефектов твердых тканей зубов. Для восстановления дефектов твердых тканей зубов рекомендуется использовать композитные материалы, гибридные стеклоиономерные цементы и амальгаму. Применение традиционных СИЦ менее предпочтительно (Level of Evidence: II, Grade of Recommendation: B) [13].
При поражении твердых тканей коронки зуба лечение проводят в несколько этапов. Вначале осторожно удаляют некротические массы из дефектов зубов вручную экскаватором, чтобы не внедриться в полость зуба, а затем вводят кальцифицирующую пасту, состоящую из равных частей порошка глицерофосфата кальция, оксида цинка и глицерина. Пасту накладывают тонким слоем на дно и стенки образовавшейся полости и закрывают временным пломбировочным материалом.
Следующий этап отсроченного лечения зубов проводят через 1-1,5 мес. Он состоит в удалении нежизнеспособных, некротизированных тканей зуба при помощи бора до минерализованного участка дентина или эмали, после чего вновь накладывают кальцифицирующую пасту и пломбируют зубы стеклоиономерными цементами.
При более глубоких поражениях устраняют имеющиеся некротические дефекты стеклоиономерными цементами и через 3-4 месяца, если этого требует косметическая реставрация передних зубов, часть стеклоиономера удаляют, а сверху накладывают композитный пломбировочный материал.
Таким образом, лучевой кариес является распространенным осложнением лучевой терапии рака орофарингеальной зоны. На сегодняшний день разнятся мнения о клинической картине, особенностях течения заболевания и тактике лечения. Нами не найдены данные в литературе о зависимости режимов фракционирования и лучевыми повреждениями зубов в ранние и отдаленные сроки, а также о влиянии конформного облучения на твердые ткани зуба. Планируем более детальное изучение проблемы.
Список литературы:
1. Черенков В.Г. Клиническая онкология: учеб. пособие для системы постдиплом. образования врачей / В.Г. Черенков. – Изд. 3-е, испр. и доп. – М.: МК, 2010. – 434 с.
2. Кропотов М.А. Общие принципы лечения больных первичным раком головы и шеи / М.А. Кропотов // Практическая онкология. – 2003. – Т.4, №1. – С.1-7.
3. Онкология: учебник для вузов / Вельшер Л.З., Матякин Е.Г., Дудицкая Т.К., Поляков Б.И. – 2009. – 512 с.
4. Алиева С.Б. Химиолучевая терапия больных с местнораспространенным плоскоклеточным раком головы и шеи/ С.Б.Алиева // Практическая онкология. – 2008. – Т.9, №1. – С.27-30.
5. Алиев Б.М., Гарин А.М., Кошалиев Э.Ш. Сравнительная оценка эффективности лучевого и химиолучевого лечения местнораспространенного рака носоглотки III-IV стадиями заболевания // Мед. радиол. – 1987. – №7. – С. 25-30.
6. Алиев Б.М., Гарин А.М., Чуприк-Малиновская Т.П. Рак носоглотки: опыт лучевого и химиолучевого лечения // Вестн. ОНЦ РАМН. – 1995. – №1. – С. 26-32.
7. Канаев С.В. Лучевая терапия злокачественных опухолей головы и шеи/ С.В.Канаев // Практическая онкология. – 2003. – Т.4, №1. – С. 15-24.
8. Чуприк-Малиновская Т.П. Рак носоглотки: вопросы диагностики и лечения // Практическая онкология. – 2003. – Т.4, №1. – С. 38-44.
9. Иванова Л.А. Профилактика постлучевых поражений зубов.//Методические рекомендации. – Пермь, 1987.
10. Барер Г.M. Изменения ультраструктуры твердых тканей зубов после местного облучения // Г. М. Барер, Л. А. Иванчикова; Г. И. Назаров // Стоматология. 1977. – №1. – С. 4-7.
11. Боровский Е.В., Сазонов Н.И. Изменение проницаемости эмали зубов после дистанционного гамма-облучения нижней челюсти // Стоматология. – 1978. – С.1-5.
12. Назаров Г.И. Изменение зубов и челюстей после локального гамма-облучения // Мед. радиология. – 1975. – №8. – С.75-76.
13. Боровский Е.В. Реставрация лучевого кариеса зубов. Клинический пример/Е.В. Боровский, И.М. Макеева, Е.А. Скатова// Стоматология детского возраста и профилактика: рецензируемый, рекомендованный ВАК научный журнал. – 2012. – Т. XI, №2. – С.11-19.
14. Wolden S.L., Zelefsky M.J., Kraus D.H. et al. Accelerated concomitant boost radiotherapy and chemotherapy for advanced nasopharyngeal carcinoma // J. Clin. Oncol. – 2001/ – Vol. 19(4). – P. 1105-1110.
Статья предоставлена журналом "Проблемы стоматологии"