
Хондроитинсульфаты (ХС) вместе с кератан-, дерматан -, гепарансульфатами и гепарином относятся к группе соединений, которые имеют общее название - сульфатированные гликозаминогликаны (ГАГ). Химический состав ГАГ, найденных в соединительной ткани (СТ) позвоночных, представлен в табл. 1.
Эта биохимическая вариабельность строения позволяет данным молекулам иметь различную молекулярную массу и плотность заряда на своей поверхности. Именно эти характеристики и определяют многочисленные свойства данных ХС.
Таблица 1. Гликозаминогликаны и их распеделение в тканях позвоночных
| № | Тип, локализация | Состав дисахаридной единицы |
| 1 | Гиалуроновая кислота
Стекловидное тело, синовия, |
Д -глюкуроновая кислота-Д-глюкозамин (dGlcUA)-(dGlcNAc) |
| 2 | Хондроитин Роговица, аорта, хрящ, кожа, кости, склера |
d-GlcUA - Д-галактозамин d-GalNAc |
| 3 | Хондроитин -4 - сульфат Хрящ, кожа, сухожилия |
d-GlcUA - d-GalNAc |
| 4 | Хондроитин-6 - сульфат Хрящ, кожа, сухожилия |
d-GlcUA - d-GalNAc |
| 5 | Гепарин Кожа, легкие, печень, сосуды |
Л-Идуроновая кислота -d-GalNAc (1-IdUA) или d-GlcUA-d-GalNAc |
| 6 | Гепарансульфат Легкие, аорта |
d-GlcUA - d-GlcNAc или 1-IdUA - d-GlcNAc |
| 7 | Кератансульфат I Роговица |
Галактоза (Сal) - d-GlcNAc |
| 8 | Кератансульфат II Хрящ |
Сal - d-GlcNAc |
| 9 | Дерматансульфат Кожа, сухожилия, склера, роговица, сердечные клапаны |
1-IdUA - d-GlcNAc или 1-IdUA - d-GalNAc |
В матриксе хряща гликозаминогликаны всегда соединены с белком и входят в состав протеогликанов. Мономер протеогликана хряща [4, 23] состоит из 50-60 цепей кератансульфата и 100 цепей ХС, которые коваленгно связаны со стержневым белком. Мономеры протеогликана (табл. 2) несут большой отрицательный заряд и являются основными блоками для построения как минимум двух видов белково-полисахаридных комплексов хрящевого матрикса. Во-первых, они формируют агрегаты с гиалуроновой кислотой, когда 100-140 прогеогликановых мономеров соединены с длинной цепью гиалуроновой кислоты. Это по истине гигантская молекула, напоминающая по строению ерш для мытья посуды и имеющая молекулярный вес до 400 х 106 дальтон [23]. Во-вторых, мономеры протеогликана при ассоциации их С-концевых участков могут образовывать димеры, которые в свою очередь взаимодействуют N-концевыми участками с молекулами гликопротеина и формируют агрегаты первого порядка. Далее образуются агрегаты более высокого порядка, в которых димеры одновременно соединены с двумя и более молекулами связующего белка [2].
| Композиция | Кол-во цепей | Мол. вес | % от общего веса |
| Белок | 1 | 2.0-3.0x105 | 7-12 |
| Хондроитинсульфат | 100 | 20000 | 80-85 |
| Кератансульфат | 50 | 5500 | 7 |
| Олигосахара | 50 | 5500 | 1-3 |
| Заряженные группы Сульфатная |
- | 4500 на молекулу | - |
| Карбоксильная | - | 4200 на молекулу | - |
| Всего: | - | 8700 на молекулу | - |
В обоих случаях боковые цепи протеогликанов, состоящие из гликозаминогликанов, переплетаются с волокнами коллагена и создают плотную трехмерную сетку, которая обеспечивает как избирательный проход через неё различных макромолекул, так и прочную пространственную стуктуру. За счет своей высокой гидрофильности цепи гликозаминогликанов сорбируют воду, и внутри хрящевого матрикса формируется герметизированная система, из которой при нагрузке на поверхности хряща выделяется жидкость, формирующая защитную пленку и обеспечивающая почти идеальное скольжение в суставе.
Возрастные изменения концентрации и качественного состава гликозаминогликанов в разных видах хрящевой ткани изучены достаточно хорошо. У позвоночных характерной особенностью качественного состава ГАГ во всех изученных видах хряща на ранних стадиях его развития является отсутствие кератансульфата [7, 13, 15,34]. У человека появление кератансульфата в хряще черепа, грудины и ребер отмечено только после 8 недель внутриутробного развития [34]. В эмбриональном хряще ГАГ представлены главным образом ХС-4 и ХС-6, а также гепарансульфатом [11, 13, 39, 50]. В процессе эмбрионального развития количество гепарансульфата в хрящевой ткани падает, а кератансульфата нарастает. Содержание хондроитинсульфатов также нарастает на ранних этапах эмбриогенеза, причем с явным преобладанием ХС-4 над ХС-6 [34]. Степень сульфатирования ГАГ также увеличивается по мере эмбрионального развития [30, 36, 46]. Начиная с постнатального периода в хрящевой ткани суммарное количество ГАГ с возрастом постепенно снижается, но при этом удельное содержание кератансульфата продолжает нарастать. Отношение ХС-4 и ХС-6 достигает максимума в раннем постнатальном периоде, а затем начинает снижаться за счет увеличения доли ХС-6 [30, 50]. Таким образом, в молодом хряще концентрация ХС-4 всегда выше, чем ХС-6, а кератансульфат в нем либо отсутствует, либо его содержание крайне мало.
В процессе дифференцировки и развития хряща обмен гликозаминогликанов в нем также меняется как в качественном, так и количественном отношении. Известно, что к 20 годам жизни человека обмен ГАГ снижается почти в 6 раз по сравнению с новорожденными [40]. Качественный состав гликозаминогликанов мочи претерпевает характерные изменения, которые хорошо согласуются с возрастным перераспределением синтеза изоформ ХС [37]. Так, у 5-летних детей ХС-4 и ХС-6 составляют соответственно 60% и 30% от общего содержания ГАГ в моче, а в 20-летнем возрасте их соотношение становится практически одинаковым [42]. В пожилом возрасте экскреция с мочой гликозаминогликанов снижается, но при этом возрастает пропорция выделяемого ХС-6. Необходимо отметить, что существует четкое соответствие между интенсивностью обмена ГАГ и коллагена. В обоих случаях максимальная интенсивность их метаболизма наблюдается в начале онтогенеза, в период формирования тканевых структур, после чего интенсивность обмена существенно снижается [3, 15]. При этом, судя по экскреции ГАГ с мочой, уровень их общего обмена достигает максимума раньше, чем уровень обмена коллагена [40]. Аналогичная ситуация имеет место и во взрослом организме, когда идут процессы регенерации СТ. В ране быстрый рост уровня гексозамина наблюдается на ранних стадиях её заживления [8]. Так, в нормальной коже содержание гексозамина составляет 450 мг/100 г сухой ткани, в 3-дневной ране - 956, в 6-дневной -790, 9-ти - 505, в 12-дневной -475 и в 15-дневной - 466 мг. Белково - полисахаридные комплексы, содержащие ГАГ, формируются на 5-6 день в продуктивную фазу роста, тогда как появление первых коллагеновых волокон отмечается только в конце этой фазы. Следовательно, синтез гликозаминогликанов и протеогликанов всегда предшествует синтезу коллагена и образованию рубцовой СТ и, скорее всего, они и определяют её тип.
ХС участвуют в формировании и самих коллагеновых волокон. При этом микрофибриллы коллагена сначала связываются олигосахарами гликопротеинов, создаются укрупненные фибриллы, которые затем с помощью цепей ГАГ, входящих в состав протеогликанов, объединяются в волокна различной толщины [3, 7]. Этот процесс идет внеклеточно, и самосборка коллагеновых волокон генетически детерминирована [6]. Необходимо отметить, что указанные свойства цепей гликозаминогликанов реализуются и тогда, когда они представлены в свободном виде. Доказательством этого являются экспериментальные данные, полученные нами в системе in vitro. Так, при смешивании растворов тропоколлагена и ХС происходит практически моментальная реакция, заканчивающаяся формированием непрозрачных преципитатов. После высушивания таких образцов можно видеть, что тропоколлаген в отсутствии гликозаминогликанов представляет из себя гомогенную массу (фото 1, а), тогда как в присутствии хондроитинсульфатов имеет четкую исчерченность, характерную для коллагеновых волокон (фото 1, б). Это свойство ХС, по-видимому, очень важно при репарации любой соединительной ткани, так как препятствует быстрому разрушению в ней коллагенового каркаса и обеспечивает, хотя и временное, но формирование матрикса из частично деградированного коллагена, который, как правило, менее устойчив к биораспаду. Создание временного матрикса имеет важное значение еще и потому, что позволяет приостановить формирование грубого рубца и обеспечить впоследствии более быстрое его замещение на обычную для данного органа соединительную ткань. Это было подтверждено нами при использовании сульфатированных гликозаминогликанов, в состав которых входил ХС-4, для формирования "мягкой" рубцовой ткани при заживлении роговицы глаза после хирургической коррекции миопии.
Фото 1. Ультраструктура преципитатов тропоколлагена.


а) б)
а) в отсутствии сульфатированных гликозаминогликанов.
б) в присутствии 100 мкг/мл хондроитинсульфата. Ув. 100000
Кроме того, обнаружено [51], что сами ХС и их соединения с жирными кислотами, например фосфатидилэтаноламин-ХС, способны маскировать возникшую эрозию хряща и подавлять разрастание паннуса. По-видимому, сульфатированные гликозаминогликаны способны частично препятствовать и врастанию сосудов в хрящевой матрикс.
Процесс формирования соединительной ткани связан с синтезом её компонентов de novo. Так как биосинтез протеогликанов практически всегда предшествует синтезу коллагена, то при введении дополнительных количеств сульфатированных ГАГ они на ранних этапах восстановления соединительной ткани способны (по принципу обратной связи) существенно освободить клетку от нагрузки по производству протеогликанов. Последнее позволяет клетке сразу приступить к биосинтезу коллагена и других компонентов матрикса, и сам процесс репарации естественно ускоряется. Это подтверждают результаты ряда исследователей после нанесения им полнослойной кожной раны [14, 17, 19] и наши данные по изучению влияния гликозаминогликанов на процессы заживления трофических язв и скорость течения процесса. При внутривенном введении 1 мг/мл или 2 мг/мл препарата сульфатированных ГАГ крысам на 1, 3, 5 и 7 дни после нанесения им полнослойной кожной раны бало отмечено ускорени закрытия таких ран (табл. 3). Можно предполагать, что и в хрящевой ткани эти свойства ХС будут реализовываться подобным образом.
Таблица 3. Влияние препарата сульфатированных ГАГ (сГАГ) на заживление полнослойной раны у крыс
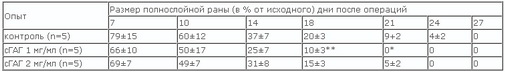
*р
Известно, что метаболизм протеогликанов и ГАГ изменяется уже на самых ранних этапах повреждения суставного хряща [4, 7, 24, 38]. Разрушение белково-полисахаридных комплексов резко изменяет свойства хрящевой ткани, делает её неустойчивой к нагрузкам и приводит к дальнейшей деградации коллагенового каркаса [22, 44]. Подобные изменения происходят и при старении [3, 25]. Как уже упоминалось, в норме цепи ГАГ свободном виде практически отсутствуют, но при патологических состояниях, когда идет разрушение белково-полисахаридных комплексов, они появляются и способны проявлять свои дополнительные уникальные свойства. Одним из них является способность хондроитинсульфатов влиять на пролиферацию и обмен хондроцитов. Правда, имеющиеся в литературе данные иногда противоречивы, но значительно чаще исследователи выявили достоверное влияние этих веществ на основные показатели обмена клеток. Было показано, что ХС и сульфатированный глюкозамин [27, 48], а также полусинтетические гиперсульфатированные полисахариды, способны стимулировать биосинтез как коллагена, так и протеогликанов в хрящевой ткани. В наших собственных исследованиях при изучении влияния препарата ГАГ, содержащего ХС-4 и кератансульфат, на культуру хондроцитов человека было установлено, что характер его действия различен и зависит от концентрации. При высоком содержании гликозаминогликанов в культуральной среде (150-200 мкг/мл) было отмечено достоверное подавление размножения хондроцитов, но при этом продукция протеогликанов и коллагена возрастала (табл. 4). В низких концентрациях (менее 10 мкг/мл) этот препарат достоверно(на 20-30%) повышал размножение хондроцитов, но не влиял на показатели обмена этих клеток. Данный эффект на клетки хряща может быть следствием как непосредственного действия хондроитинсульфатов через построение определенного типа матрикса или встраивания их в клеточную мембрану, так и в результате метаболизации цепей гликозаминогликанов и утилизации промежуточных метаболитов. Такими соединениями являются гексозамины, сахара и сульфаты. Для всех этих соединений известно, что они могут стимулировать и рост, и обмен хрящевой ткани [18]. Существует достаточное количество работ о влиянии сульфатированного глюикозамина на пролиферацию и обмен хонд-роцитов [27, 49]. Нет необходимости говорить о роли Сахаров потому, что они используются клеткой во многих обменных реакциях. Что же касается сульфата, то даже при незначительном его снижении в биологических жидкостях (с 0,3 mМ до 0,2mМ) наблюдается резкое, более чем на одну треть, снижение продукции протеогликанов в хрящевой ткани человека [32, 33].
Таблица 4. Влияние гликозаминогликанов на обмен хондроцитов человека в культуре ткани
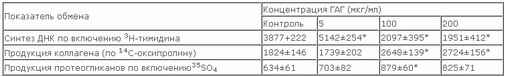
*различия по сравнению с контролем достоверны (р
Было установлено [12, 29], что ХС способны подавлять синтез липидов. При введении ХС внутривенно, подкожно или перорально у экспериментальных животных отмечалось значительное снижение уровня сывороточных липидов. Эти наблюдения легли в основу применения ХС в качестве препаратов для предотвращения и лечения артеросклероза. Положительное влияние ГАГ на сосудистую систему было отмечено и в наших исследованиях, проведенных у больных системной склеродермией. Оценка состояния микроциркуляции методами лазер-Допплер флуометрии и клиренса 133Хе, проведен нами совместно с проф. Э.С.Мач, показала (табл. 5), что препараты ГАГ, содержащие ХС-4 и кератансульфат, при локальном их применении достоверно по сравнению с контролем повышали кровоток в предплечье и в кончике пальца. Улучшение происходило как за счет уменьшения вазоспазма сосудов, так и вследствии антифиброзного действия данных соединений. Можно предположить, что ХС способны также улучшать кровоток в синовиальной ткани и в субхондральной зоне кости, приводя к стабилизации показателей обмена хряща.
Таблица 5. Влияние препаратов, содержащих сульфатировапные ГАГ, на состояние микроциркуляции у больных системной склеродермией
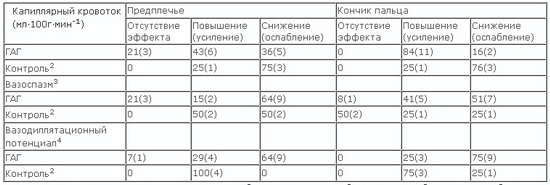
Примечания: величины представлены в % от общего количества обследованных больных, в скобках указано число больных в каждой группе.
* 1. Капиллярный кровоток исследовался методом клиренса 133Хе из внутрикоженого депо.
* 2. В качестве контроля использовался местно изотонический раствор натрия хлорида.
* 3. Вазоспазм (% уменьшения кровотока во время пробы Вальсальвы) исследовался методом лазер-
Допплерфлуометрии
* 4. Вазодилатационный потенциал методом лазер-Допплер флуометрии оценивался по изменению
(в %) кровотока после 3-минутного местного воздействия источником тепла при t 42 С.
Недавно было обнаружено [16], что ХС в системе in vitro подавляют апоптоз, вызванный закисью азота. Предобработка хондроцигов кролика смесью ХС в концентрации 100 мкг/мл в 70% случаев снижала количество гибнущих клеток в среднем на 28%. Этот эффект пропорционально зависел от времени воздействия закиси азота.
Одним из наиболее известных и важных свойств сульфатированных гликозаминогликанов является их способность подавлять активность ферментов, принимающих участие в разрушении межклеточного матрикса соединительной ткани. Они способны подавлять активность гиалуронидазы и эластазы гранулоцитов [9, 10], кислых катепсинов [31], коллагеназы [20], лизосомальных гидролаз, сериновых протеиназ [14] и ряда других ферментов [21, 45]. Подобными свойствами обладает и сульфатированный гликозамин [48]. По нашим собственным наблюдениям препараты ГАГ in vitro в концентрации 100 мкг/мл полностью подавляли активность 0,1% раствора пепсина, что прямо доказывает их способность снижать деятельность кислых протеиназ, которая резко повышена в условиях воспаления.
Кроме того, сульфатированные гликозаминогликаны способны частично блокировать действие свободных кислородных радикалов. В эксперименте на культуре хондроцитов человека мы показали,что смесь ХС-4 и кератансульфата, а также артепарон и румалон в концентрациях от 100 до 200 мкг/мл на 30-40% подавляют синергическое действие коллагеназы и свободных кислородных радикалов [5]. Близкие результаты были недавно получены и другими исследователями, которые показали, что ХС обладают защитным действием в отношении влияния кислородных радикалов на клеточные мембраны хондроцитов [47].
Противовоспалительный эффект гликозаминогликанов связан, по-видимому, не только с их влиянием на активность ферментов и подавление перекисного окисления липидов. Общеизвестно, что эти полианионные соединения очень хорошо связывают различные молекулы. Цепи ГАГ могут менять конформацию молекул (например, ферментов, факторов роста и других цитокинов) и таким образом снижать их биологическую активность. ГАГ также способны блокировать антигенные детерминанты, препятствуя развитию иммунных и аутоиммунных процессов [28]. Было показано [49], что ХС и сульфатированный гликозамин обладают определенным противоотечным действием, хотя не способны предотвратить отек, уже иницированный такими медиаторами воспаления как брадикинин, серотонин или гистамин. Противоотечное действие сульфатированных ГАГ, по-видимому, осуществляется за счет двух механизмов. Во-первых, гликозаминогликаны забирают на себя воду и тем самым изымают её из ткани. Во-вторых, ГАГ способны прерывать на начальных этапах афферентное звено воспаления, осуществляемое макрофагами. ХС, связывая полностью или частично продукты распада и, возможно, часть медиаторов, блокируют хемотаксис и таким образом лишают макрофаги возможности появляться в очаге воспаления, распознавать антигены и высвобождать соответствующие медиаторы. К такому заключению мы пришли в результате изучения гистологических препаратов, отражающих динамику формирования рубца роговицы у экспериментальных животных. В случае местного применения гликозаминогликанов в постоперационный период в зоне формирования рубца отмечалось практически полное отсутствие макрофагов и отека роговицы. Позднее влияние ХС и их частично деполимеризованных производных на макрофаги было доказано в специальных исследованиях [47]. Так, ХС подавляли направленный хемотаксис лейкоцитов человека, индуцированный зимозан-акти-вированной сывороткой, снижали фагоцитоз и высвобождение лизоцима. Сравнение с нестероидными противовоспалительными препаратами показало, что ХС были более эффективны во время клеточной фазы воспаления, чем на стадии отека. Однако, по данным Omata Т. и соавт. [43], ХС при скармливании крысам способны подавлять потерю протеогликанов хряща в ответ на введение брадикинина. Кроме того, показано, что предварительное введение животным протеогликанов, богатых ХС, предотвращает развитие артрита, индуцированного микобактерией туберкулеза [28].
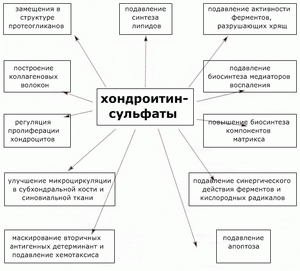
К сожалению, многие механизмы действия ГАГ и ХС пока изучены недостаточно, но уже сейчас можно с уверенностью утверждать (схема 1), что ГАГ в целом и ХС в частности оказывают влияние на многие показатели обмена соединительнотканного матрикса.
К настоящему времени на фармацевтическом рынке имеется ряд препаратов, содержащих различные гликозаминогликаны и их аналоги. Наиболее известными из них являются "Структум" и "Хондросульф". Эти препараты состоят из смеси нативных ХС-4 и ХС-6 в отношении, близком к таковому в хряще взрослых здоровых людей. За последние несколько лет опубликован ряд работ [1, 17, 18, 35], показывающих, что эти препараты, а также сульфатированный гликозамин [27] эффективны при остеоартрозе и других дегенеративных заболеваниях суставов. Положительным качеством сульфатированных ГАГ является практически полное отсутствие побочного действия на желудочно-кишечный тракт, почки, свертывающую систему крови и гомеостаз в целом. Можно предположить, что эти препараты окажутся перспективыми для применения не только в ревматологии, но и в других областях медицины.
Статья предоставлена ООО "Конектбиофарм" bioimplantat.ru