
д.м.н., проф. В.В. АФАНАСЬЕВ,
Кафедра челюстно-лицевой травматологии
стоматологического факультета МГМСУ им. А.И. Евдокимова,
к.м.н. В.Е. МАМОНОВ,
Г.В. МИШИН
ФГБУ «Гематологический научный центр» Минздрава России
Немногие стоматологи готовы осуществлять прием больных гемофилией в стоматологическом кабинете не только из-за опасности возникновения геморрагических осложнений, но еще и по причине высокой стоимости заместительной гемостатической терапии и послеоперационного ухода [15].
Удаление зубов у больных гемофилией требует мультидисциплинарного подхода и совместного сотрудничества стоматолога и гематолога [8]. Специалист-гематолог, владеющий методами заместительной гемостатической терапии, осуществляет общий гемостаз в дооперационном, интра- и послеоперационном периоде ведения больного. Общий гемостаз заключается в ликвидации дефицита плазменных факторов свертывания крови и осуществляется путем введения концентратов VIII и IX факторов свертывания крови. Используются препараты, обеспечивающие активацию фактора X на тромбоцитарной поверхности, например рекомбинантный фактор VII [2]. Хирург-стоматолог обеспечивает местный (хирургический) гемостаз в лунке удаленного зуба. Местный гемостаз заключается в формировании и защите сгустка крови в лунке, тем самым минимизирует возможность развития вторичного луночкового кровотечения. Эти мероприятия создают оптимальные условия для заживления лунки и устраняют возможность развития альвеолитов. Например, некоторые авторы рекомендуют укладывать на лунку удаленного зуба марлевый тампон, пропитанный транексамовой кислотой на 30— 60 мин [15]. При этом следует помнить, что действие препарата кратковременное. M. Racocz и соавт. [8] применили для предотвращения кровотечения из лунок удаленных зубов у больных тяжелой гемофилией фибриновый клей, при этом у 9 из 12 пациентов были отмечены вторичные кровотечения из лунок. M. Suwannuraks и соавт. [18] считали, что использование других веществ, например цианакрилатного клея, целлулоидных шин, фибринового клея, может вызвать неприемлемое количество геморрагических осложнений. Кроме того, отдельные авторы отказываются от использования фибринового клея еще и по причине высокого риска развития вирусных инфекций [12—14, 16].
M. Ade Filho и соавт. [14] в 2006 г. доложили об эффективном использовании фибринового герметика у больного с болезнью Виллибранда, даже без применения общей заместительной гемостатической терапии. Пока правда в одном случае, что, разумеется, не может считаться достаточно достоверным.
Brahim A. Kaddour и соавт. [7] успешно использовали у 37 детей с врожденными коагулопатиями СО2лазер с последующим применением термопластичных шин для защиты лунок. В то же время авторы в нескольких случаях отметили развитие альвеолитов.
D. Torres-Lagares и соавт. [16] использовали биоадгезивный гель на основе хлоргексидина для профилактики альвеолярных остеитов (альвеолитов), который они вводили в лунки после удаления третьих моляров. Авторы отметили, что почти у 1/4 пациентов наблюдалось вторичное луночковое кровотечение.
J. Kim и соавт. [13] указали, что применение резорбируемой желатиновой губки в лунке после удаления третьих моляров значительно снизило количество послеоперационных болей, отеков и кровотечений.
Таким образом, проблема профилактики воспалительных осложнений после удаления зубов у больных с врожденными коагулопатиями до настоящего времени не решена. Существующие современные способы наряду с достоинствами имеют серьезные недостатки. В этой связи мы провели работу по изучению возможностей использования мембран из силиконовой резины медсил для изоляции и защиты кровяного сгустка в лунке.
Цель работы — оптимизация заживления лунок после удаления зубов у больных гемофилией.
Материал и методы
В стационаре Гематологического научного центра Минздрава России (ГНЦ МЗ РФ) нами проведено удаление зубов у 47 больных, страдающих различными формами гемофилии. Все пациенты были мужчинами, средний возраст — 38 лет. Большинство больных имели тяжелую форму гемофилии (уровень VIII или IX фактора свертываемости в крови менее 1%), гемофилия средней степени тяжести была у 1 больного (уровень фактора 1 — 5%) и легкой степени — у 1 больного (6—30%). Ингибиторной формой гемофилии (появление в крови больных иммунных ингибиторов класса IgG, снижающих эффект заместительной гемостатической терапии) страдали 7 пациентов. Всего у 47 пациентов удалили 139 зубов: 136 — по поводу хронического периодонтита, 2 — подвижных молочных зуба с физиологической резорбцией корней и 1 — по поводу перелома корня.
Удаление зубов проводилось по общепринятой методике с соблюдением всех методических рекомендаций с наибольшей аккуратностью. Сепарацию десны производили, стараясь не повредить ее и не нанести дополнительную травму окружающей зуб десне. Для извлечения зуба использовали обычные щипцы (клювовидные и штыковидные). После извлечения корня проводили тщательный кюретаж лунок, удаляли все грануляции и мелкие костные фрагменты. Особое внимание обращали на острые костные края, сглаживая их кюретажной ложкой.
В зависимости от способа хирургического (местного) гемостаза и способа изоляции кровяного сгустка в лунке, всех больных разделили на 4 группы.
В 1-ю группу вошли 27 пациентов. Методика хирургического гемостаза у них состояла в следующем: лунки после удаления туго тампонировали гемостатической губкой (сургигель, тахокомб, спонгостан), на края десны вокруг лунок накладывали сближающие швы из нерезорбируемого материала. Десну по краям лунок сводили между собой как можно плотнее, до появления признаков ишемизации слизистой оболочки (рис. 1).
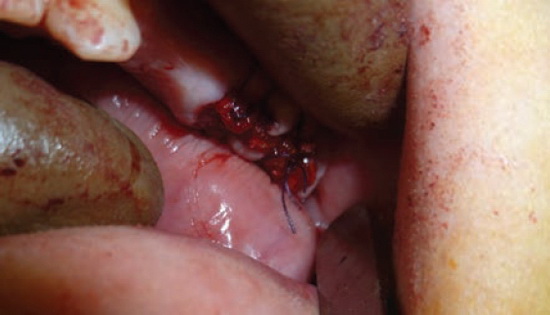
Рис. 1. Лунки удаленных зубов 2.6; 2.7 тампонированы гемостатической губкой, наложены сближающие швы.
Во 2-ю группу вошли 19 пациентов. В качестве раневой повязки после удаления зубов использовали отечественные силиконовые мембраны медсил толщиной 0,2 мм, прочностью при растяжении около 7,0 МПа, прозрачного цвета, вакуумно упакованные, мембраны возможно автоклавировать при температуре 130 °С. Методика хирургического гемостаза: силиконовую мембрану помещали на устье лунки и сшивали края мембраны с краем десны непрерывным швом Мультановского из нерезорбируемого материала (рис. 2, 3).
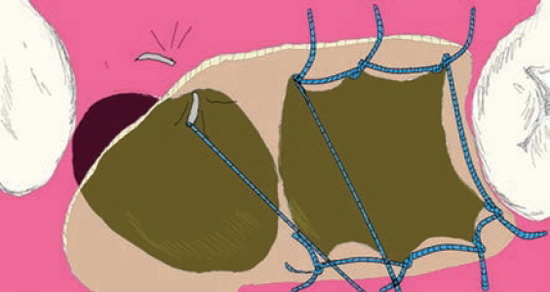
Рис. 2. Схема фиксации мембраны из силиконовой резины к краям лунки с помощью шва Мультановского.
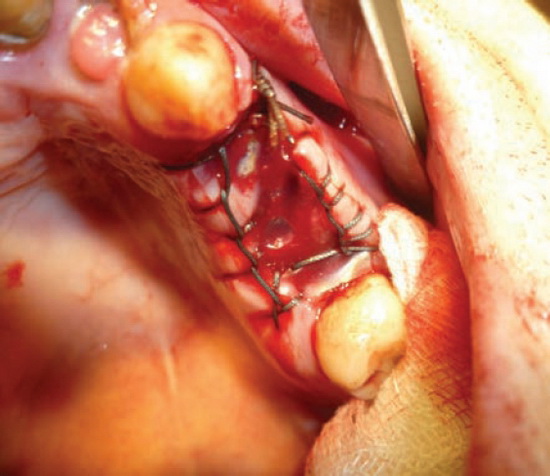
Рис. 3. Больной С. Лунки 2.5; 2.6; 2.7 после удаления закрыты силиконовой мембраной. Через прозрачную мембрану виден полноценный сгусток крови.
В 3-ю группу вошли 7 пациентов. В качестве раневой повязки использовали йодсодержащие марлевые турунды с аквазаном или йодоформом. Методика хирургического гемостаза: лунки после удаления зуба туго тампонировали марлевой турундой, пропитанной йодоформом или аквазаном (рис. 4).
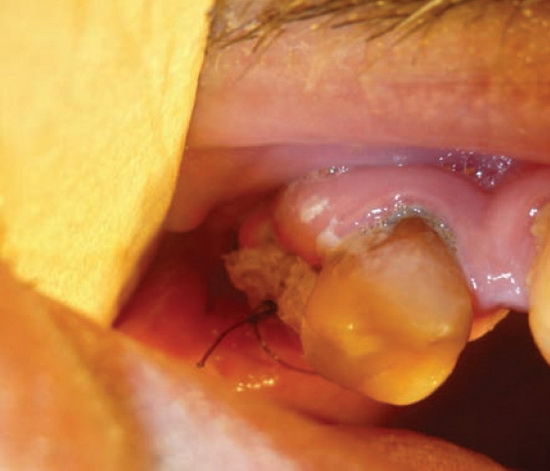
Рис. 4. Больной Л. Лунка удаленного 1.8 тампонирована турундой с аквазаном, наложен сближающий шов, 4-е сутки после удаления.
Края лунки сшивали нерезорбируемым шовным материалом. Десну по краям лунок сводили между собой как можно плотнее, до появления признаков ишемизации слизистой оболочки.
В 4-ю группу вошли 3 пациента. Методика хирургического гемостаза: лунку ничем не тампонировали, а края десны в области лунки максимально сближали кисетным швом (рис. 5).
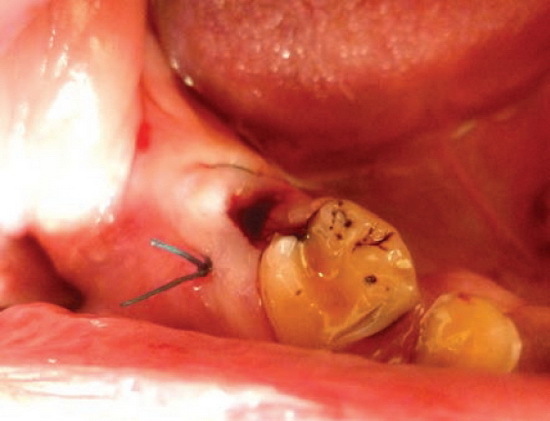
Рис. 5. Больной А. На лунку зуба 4.7 наложен кисетный шов.
Девять больных были отнесены к нескольким группам одновременно, так как у данных больных использовали сразу несколько способов изоляции лунки после удаления зубов.
Всего выполнили 56 операций удаления зуба. Одномоментно удаляли не более 3—4 однокорневых зубов или не более 1 многокорневого зуба [4].
Больным всех 4 групп в пред- и послеоперационном периоде проводилась заместительная гемостатическая терапия с обязательной консультацией специалиста гематолога. Общая заместительная гемостатическая терапия заключалась во внутривенном введении VIII и IX факторов свертывания крови, а также в случае наличия у больного ингибиторной формы гемофилии (7 пациентов) вводился коагил VII.
В качестве обезболивания у пациентов с легкой, средней и тяжелой степенью гемофилии независимо от формы заболевания (А или В) в основном использовали проводниковую и инфильтрационную анестезию. Для обезболивания у больных с ингибиторной формой гемофилии применяли исключительно эндотрахеальный наркоз. В послеоперационном периоде оценивали общее состояние больных, а также местное состояние послеоперационной раны по следующим критериям: жалобы пациентов, наличие кровотечения из лунок удаленных зубов, развитие отека. Обращали внимание на сроки появления грануляций в постэкстракционных лунках, а также начало и завершение периода эпителизации лунок после удаления зубов. Также провели планиметрические измерения лунок с целью определения средней скорости их заживления после удаления зубов. Планиметрические измерения проводили с помощью полосок миллиметровой бумаги или линейки, измеряли площадь устья лунки и ее глубину, что впоследствии позволяло вычислить объем лунки. Сроки измерений старались приурочить к фазам течения раневого процесса: появление грануляций (2—3-и сутки), начало эпителизации (6—7-е сутки) и окончание эпителизации лунок (не ранее 12—14-х суток). Среднесуточную скорость заживления лунок оценивали в процентах по формуле: (V – Vn)/ Vt •100, где V — объем раны (лунки) при предыдущем измерении; Vn — объем раны (лунки) при данном измерении; t — число дней между измерениями. Статистическую обработку проводили с использованием метода вычисления уровня статистической достоверности различия между двумя средними по критерию Стьюдента. Результат считали достоверным или статистически значимым при значении р≤0,01.
Результаты и обсуждение
Большинство санированных нами больных страдали тяжелыми формами гемофилии — 38 (81%) и ингибиторной формой — 7 (15%). Эти категории пациентов в течение жизни подвергаются систематической трансфузии препаратов крови (плазма, криопреципитат), поэтому подавляющее число пациентов — 41 (87,2) болели или являются вирусоносителями гепатитов В и/или С. В связи с этим все хирургические вмешательства в челюстно-лицевой области мы выполняли с применением специальных перчаток, защитных масок или очков, а использованные инструменты и приспособления подвергали особой санитарной обработке.
Всего проведено 56 операций удаления зубов, количество операций соответствовало количеству больных, так как у 9 человек использовали разные методы местного (хирургического) гемостаза одновременно. Наибольшее число операций было в 1-й группе, где хирургический гемостаз в постэкстракционных лунках осуществляли с применением гемостатической губки — 27 операций, удалено в общей сложности 87 зубов — 62,6% от общего количества удаленных зубов.
Во 2-й группе, где в качестве защитной повязки применяли силиконовую мембрану, провели 19 операций, во время которых удалили 36 (25,9%) зубов.
В 3-ей группе с использованием йодсодержащей турунды провели 7 операций, при этом удалили 11 (7,9%) зубов. В 4-й группе, где постэкстракционная лунка заживала открытым способом, а в качестве хирургического гемостаза использовали сближающие швы, провели 5 операций, удалено 3 (3,6%) зуба.
Анализ основных клинических параметров показал, что жалобы на боли в лунках после удаления зубов в 1-й группе предъявляли 13 (48,1%) пациентов. Постэкстракционное кровотечение в данной группе отметили у 10 (37,04%) из 27 пациентов. В 2-й группе, где для местного (хирургического) гемостаза применяли силиконовую мембрану, эти показатели были существенно ниже, боль в лунках отметили лишь 3 (15,7%) из 19 больных, причем продолжительность луночковых болей после удаления была минимальной по сравнению с другими тремя группами, в среднем до 1 сут. Постэкстракционные кровотечения из лунки наблюдались только у 2 (10,3%) человек, хотя статистически значимых различий нет.
Небольшая по количеству больных 4-я группа создавалась из числа пациентов, у которых корни зубов были сильно резорбированы и костный компонент лунок отсутствовал, корни зубов находились практически в мягких тканях. Поэтому мы сочли целесообразным оставить лунки открытыми и наложили лишь сближающие швы. Наши надежды оправдались, кровотечения после удалений в данной группе не было. 1 (33,3%) из 3 человек жаловался на боль в лунке после удаления.
В 3-й группе больных постэкстракционные боли в лунках и кровотечение отмечали все 7 (100%) больных. Боль носила постоянный, ноющий характер. По этим параметрам силиконовая мембрана достоверно отличалась от марлевой турунды (р≤0,01). Кроме этого, при осмотре тампонированные йодсодержащими марлевыми турундами лунки выглядели неопрятно, были покрыты остатками пищи (см. рис. 4). Больные жаловались на неприятный запах. Поэтому в ряде случаев марлевые турунды приходилось удалять досрочно, не ожидая созревания грануляций и заполнения ими всего объема лунки примерно к 4—5-м суткам, риск развития вторичного кровотечения при этом повышался (рис. 6, 7).
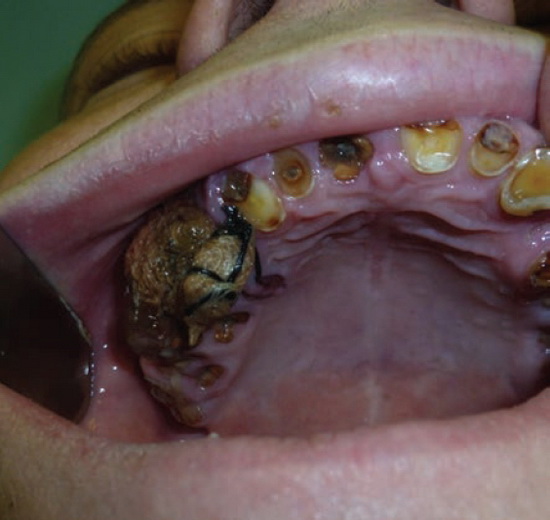
Рис. 6. Больной Ф., 33 г. Йодоформная турунда в лунке удаленного зуба 1.5 практически полностью выпала, осклизнилась и не несет своей функции. Удалена на 5-е сутки.
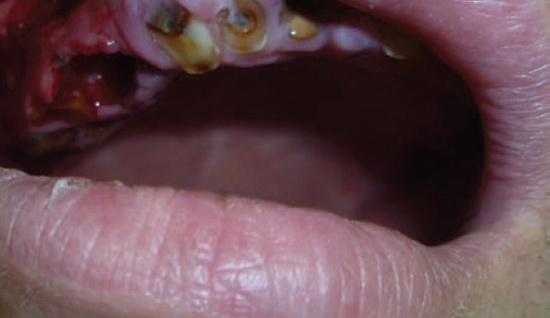
Рис. 7. Больной Ф. Лунка сразу после удаления турунды. Грануляции определяются только по стенкам лунки.
При послеоперационном осмотре у больных обращали внимание на отек мягких тканей альвеолярного гребня в области удаленных зубов. Так во 2-й группе с применением силиконовой мембраны мы отметили наиболее оптимальное заживление. Только у 3 (15,7%) из 19 больных мы обнаружили отек мягких тканей в области окружающей десны. Отек мягких тканей мы отметили у 16 (59,%) из 27 больных 1-й группы; у всех 7 (100%) больных 3-й группы и у 1 (33,%) из 3 пациентов 4-й группы.
По данному клиническому показателю 2-я группа больных с применением в качестве раневой повязки силиконовой мембраны статистически значимо отличалась от 1-й и 3-й групп (р≤0,01).
Статистически значимых различий между клиническими признаками у больных 2-й и 4-й групп не обнаружено. Более того, длительность выраженных отеков мягких тканей также оказалась наименьшей во 2-й группе больных. В среднем отеки при использовании мембраны из силиконовой резины наблюдали до 1,3±0,8 сут, по сравнению с 6 сут в случае «открытой лунки» в 4-й группе. При сравнении этих двух групп выявлены статистически значимые различия (р≤0,01). В 1-й и 3-й группах выраженные отеки мягких тканей проходили примерно одинаково — через 4,1±2,6 и 3,4±2,6 сут. Однако достоверных различий со 2-й группой не отметили.
Кроме того, в 1-й группе с применением гемостатической губки мы отметили 2 случая возникновения гематом. Однако они были ограниченными, не носили деструктивный характер и располагались в области 2—3 зубов.
По поводу данных гематом специальных лечебных мероприятий не проводили. Гематомы рассасывались самостоятельно к 3—4-м суткам. У 1 больного из этой группы с ингибиторной формой гемофилии А на 6-е сутки после удаления зубов 2.6, 2.7 в результате труднокупируемого, неинтенсивного кровотечения сформировался кровяной сгусток огромных размеров, из-за которого больной не мог закрыть рот (рис. 8).
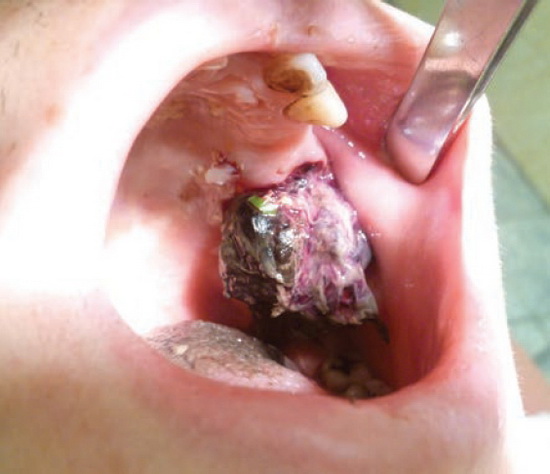
Рис. 8. Больной Д. 6-е сутки после удаления зубов 2.6, 2.7. Виден большой сгусток крови. Местный гемостаз осуществлялся с использованием гемостатической губки тахокомб.
После удаления сгустка и замены препарата общей заместительной гемостатической терапии кровотечение удалось остановить. Однако данное осложнение увеличило сроки окончательной эпителизации лунок до 1 мес.
Часто после удаления рядом стоящих зубов лунки не имели четких границ между собой и представляли единую постэкстракционную рану. Наибольший объем такие раны имели во 2-й группе — 1382 мм3, наименьший — в 3-й группе — 303 мм3. Больные 1-й и 4-й групп заняли по этому параметру промежуточные позиции: соответственно 1178,8 и 618,7 мм3. Однако, статистически значимых различий по данному критерию при сравнении четырех групп между собой не обнаружили.
Несмотря на бóльший средний объем постэкстракционных ран во 2-й группе, их заживление проходило достоверно лучше, чем у пациентов из других групп.
Так, в постэкстракционных лунках, изолированных силиконовой мембраной, грануляции образовались в среднем через 2,5±0,6 сут, что в 2 раза быстрее, чем в лунках, тампонированных йодсодержащими турундами, где гранулирование начиналось через 4,5±1,5 сут (р≤0,01). В лунках у пациентов 1-й и 4-й групп грануляции начинали образовываться также позднее, чем у пациентов 2-й группы: примерно через 3,7±1,4 и 3 сут, хотя достоверных различий нет. Окончательная эпителизация лунок под силиконовой мембраной наступала достоверно раньше, чем в группе пациентов с гемостатической губкой. В среднем уже через 14,3±4,6 сут мы наблюдали под прозрачной мембраной образование эпителиальной ткани, после чего мембрану удаляли.
В 1-й группе окончательная эпителизация наступала в среднем только через 19,9±6,1 сут (р≤0,01). В 3-й группе лунки эпителизировались через 18,4±3,4 сут и в 4-й группе — через 16±4,3 сут.
Относительно более позднее заживление постэкстракционных лунок связано с тем, что, стараясь избежать геморрагических осложнений, мы туго тампонировали губкой или йодоформной турундой весь объем лунки, поэтому полноценный сгусток крови не образовывался. В дальнейшем организм тратил дополнительные время и силы на частичную или полную резорбцию материала, или же на выталкивание материала из лунки при помощи грануляций, рост которых и последующая эпителизация при этом существенно замедлялись.
Сущность методики хирургического гемостаза с использованием мембраны из силиконовой резины совершенно иная. Мембрана пришивается к краям слизистой оболочки десны, окружающей лунку, по периметру (см. рис. 2). Причем весь объем лунки в подмембранном пространстве остается свободным для формирования и последующей организации сгустка крови. При этом мембрана не только удерживает сгусток в лунке, но и защищает его от возможного разрушения вследствие воздействия на него механических и химических раздражителей (пища, фибринолитические свойства слюны). Сравнив данные средней скорости заживления постэкстракционных лунок в 1—4-й группах пациентов, мы не нашли статистически значимых различий, тем не менее следует признать, что скорость заживления во 2-й группе была несколько выше — 13,1±6,4%, чем в остальных трех группах (в 1-й группе — 11,1±5,1%, в 3-й — 12,0±2,4%, в 4-й — 10,3±6,1%).
Швы снимали во всех четырех группах не ранее 7-х суток, после образования зрелых грануляций или начала эпителизации, чтобы предотвратить вторичное кровотечение. Тем не менее у больных 1-й и 3-й групп отметили высокий процент (37 и 29% соответственно) ранней (3—4-е сутки) несостоятельности швов в виде частичного или полного их прорезывания. Мы связываем этот факт с избыточным их натяжением.
Надежность фиксации силиконовой мембраны позволяла удерживать ее на раневой поверхности до 14 сут и более вплоть до полной эпителизации лунки (рис. 9).
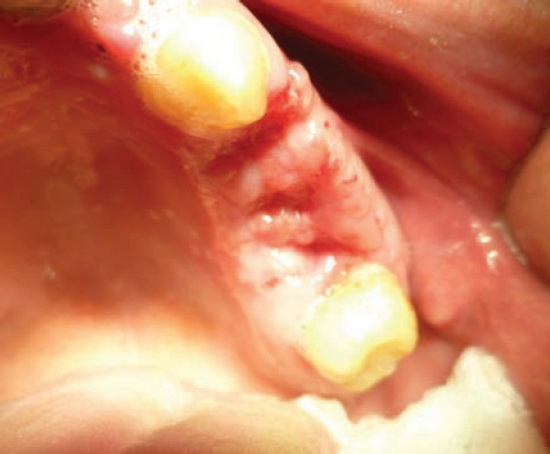
Рис. 9. Больной С. на 11-е сутки после удаления зубов 2.5; 2.6; 2.7. Мембрана удалена. Лунки полностью эпителизировались.
В одном наблюдении мембрана отвалилась из-за погрешностей в технике ее фиксации на 6-е сутки, в другом случае пациент частично снял мембрану сам без объяснения причин, после чего ее пришлось полностью убрать, при этом кровотечения не отметили. В 4-й группе случаев несостоятельности швов не было. Достоверных различий между группами по данному критерию нет.
Заключение
Таким образом, результаты нашего исследования показали, что силиконовая мембрана может быть использована в качестве раневой повязки для обеспечения местного гемостаза в постэкстракционных лунках у больных гемофилией. Раневая повязка из силиконовой мембраны обеспечивает наилучшее формирование, стабильность и последующую организацию сгустка крови. Силиконовая мембрана, фиксированная к краям десны постэкстракционных лунок непрерывным швом, обеспечивает герметизацию подмембранного пространства и защищает кровяной сгусток от механических и химических раздражителей, позволяя свести к минимуму риск развития вторичного луночкового кровотечения. Способ местного гемостаза с применением силиконовой мембраны демонстрирует лучшие результаты по основным критериям заживления постэкстракционных лунок по сравнению с гемостатической губкой, йодсодержащей турундой и с заживлением лунок «открытым способом». Методика местного гемостаза в постэкстракционных лунках у больных гемофилией с использованием силиконовой мембраны может быть применена только в сочетании с общей заместительной гемостатической терапией.
Список литературы:
1. Беляков Ю.А. Стоматологические проявления наследственных болезней и синдромов. М: Медицина 1993: 185—187.
2. Мамонов В.Е., Плющ О.П., Кудрявцева Л.М. и др. Трансфузионная терапия наследственных нарушений свертывания крови. Очерки производственной и клинической трансфузиологии. М: Ньюдиамед 2006: 398—420.
3. Московский городской стандарт лечения взрослых (старше 18 лет) больных гемофилией а и в. 20 сентября 2004 г.
4. Пермякова Н.Е. Комплексная профилактика вторичных луночковых кровотечений после удаления зубов у больных гемофилией: Автореф. дисс. ... канд. мед. наук. Ижевск: Ижевская государственная медицинская академия 2005. 27 с.
5. Руководство по гематологии: В 2 т. Под ред. И. Воробьева. 2-е изд. перераб. и доп. М: Медицина 1985. 368 с.
6. Bartlett J.A., Sweeney J.O. Exodontia in Combined Factor V and Factor VIII. Deficiency. J. Oral Maxofac Surg 1985; 43:
7: 537—539. 7. Kaddour Brahim A., Stieltjes N., Roussel-Robert V. et al. Dental extractions in children with congenital coagulation disorders: therapeutic protocol and results. Rev Stomatol Chir Maxillofac 2006; 5: 331—337.
8. Racocz M., Mazar A., Varon D. et al. Dental extractions in patients with bleeding disorders. The use of fibrin glue. Oral Surg Oral Med Oral Pathol 1993; 75: 280—282.
9. Tock B., Drohan W., Hess J. et al. Haemophilia and advanced fibrin sealant technologies. Haemophilia 1998; 4: 449—455.
10. Frachon X., Pommereuil M., Berthier A.M. et al. Management options for dental extraction in hemophiliacs: a study of 55 extractions (2000—2002). Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2005; 3: 270—275.
11. Marquez J.L., Vinageras L. et. al. Hemophilic pseudotumor of the inferior maxilla. Oral Surg 1982; 53: 4: 347—350.
12. Martinowitz U., Varon A., Heim M. The role of fibrin tissue adhesive in surgery of haemophilia patients. Haemophilia 1998; 4: 443—448.
13. Kim J.C., Choi S.S., Wang S.J. et al. Minor complications after mandibular third molar surgery: type, incidence, and possible prevention. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006; 2: 4—11.
14. Filho Ade M., dos Santos R.S., Costa J.R. et al. Oral surgery with fibrin sealants in patients with bleeding disorders: a case report. J Contemp Dent Pract 2006; 3: 106—112.
15. Zanon E., Martinelli F., Bacci C. et al. Proposal of a standard approach to dental extraction in haemophilia patients. A case-control study with good results. Haemophilia 2000; 6: 533—536.
16. Torres-Lagares D., Gutierrez-Perez J.L., Hita-Iglesias P. et al. Randomized, double-blind study of effectiveness of intra-alveolar application of chlorhexidine gel in reducing incidence of alveolar osteitis and bleeding complications in mandibular third molar surgery in patients with bleeding disorders. J Oral Maxillofac Surg 2010; 6: 1322—1326.
17. Martinowitz U., Schulman S., Horoszowski H. et al. Role of fibrin sealants in surgical procedures on patients with haemostatic disorders. Clin Orthop 1996; 328: 65—75.
18. Suwannuraks M., Chuansumrit A., Sriudomporn N. The use of fibrin glue as an operative sealant in dental extraction in bleeding disorders. Haemophillia 1999; 5: 106—108.
"Российская стоматология".
Рекомендуем оформить подписку на журнал.