
Как показывает повседневная практика, одной из важнейших проблем, с которой сталкиваются врачи-стоматологи всего мира, является проблема регенерации костной ткани вследствие различных хирургических вмешательств в челюстно-лицевой области, таких как осложненные экстракционные и реконструкционные вмешательства, проведение парадонтологического и имплантологического лечения, а также различных костнопластических операций.
Для решения этих проблем применяются различные отечественные и зарубежные препараты, созданные на основе неорганического матрикса твердых тканей человека – гидроксиапатите и b-трикальцийфосфате, содержащих химические элементы в таких же ионных формах, в которых они находятся в живых организмах. Так же в стоматологической практике применяются препараты, изготовленные из натуральной костной ткани крупного рогатого скота. Но в связи с многочисленными вспышками заболеваний животных, в частности “Коровьего бешенства”, в Европе в последнее время наибольший интерес проявляется к синтетическим препаратам. Положительный результат при применении подобных препаратов во многом зависит от компании – производителя, в частности методики синтеза и, как следствие, качественных характеристик.
Введенные синтетический гидроксиапатит и b-трикальцийфосфат рассасываются частично или полностью, в зависимости от степени кристалличности, и активируют остеогенез. Усиливают пролиферативную активность остеобластов и стимулируют процессы репаративного остеогенеза на месте введения, а так же задерживают восполительные процессы в костной ране. Характеризуются биосовместимостью с организмом человека и не вызывают реакции отторжения.
Материал БИАЛЬГИН на основе гидроксиапатита кальция включенного в полисахаридную матрицу альгината натрия,является высокочистым, полностью резорбируемым с ярко выраженным остеопластическим действием.
Биоактивный остеопластический материал БИАЛЬГИН® представляет собой гранулы на основе аморфного, нанодисперсного (5-10 нм), полностью резорбируемого гидроксиапатита кальция, включенного в полисахаридную матрицу альгината натрия.
По химическому составу, технологии синтеза (ПАТЕНТ РФ 2004 г.) и клинической эффективности БИАЛЬГИН® не имеет аналогов в России и за рубежом.
Высокая клиническая эффективность остеопластического материала БИАЛЬГИН® подтверждена доклиническими и клиническими испытаниями в ведущих институтах и клиниках России, таких как Центральный научно-исследовательский институт стоматологии, Центральная стоматологическая поликлиника Федерального управления медико-биологических и экстремальных проблем при МЗ РФ и др..
БИАЛЬГИН® предназначен для заполнения и восстановления костных дефектов в качестве остеопластического материала, оптимизирующего регенерацию костной ткани в клинике общей и челюстно-лицевой хирургии, в хирургической стоматологии а так же в травматологии и ортопедии. По гранулометрическому составу разделен на фракции 50-250, 250-500, 500-1000, 1000-2000, 2000-3000мкм (рис.1).
Рис 1.
Новизна материала БИАЛЬГИН® заключается в разработанной и запатентованной технологии синтеза (ПАТЕНТ РФ 2004) биоактивного, аморфного, нанодисперсного гидроксиапатита кальция, единственным продуктом которого является микрогранулят с диаметром гранул - 0,5 - 1 мкм. Микрогранулы в свою очередь состоят из нанодисперсных, эпитаксиально расположенных частиц гидроксиапатита кальция размером 5-10 нм и волокон, неплотно сформированных из тех же частиц, включенных в полисахаридную матрицу (рис.2).

Рис.2 Нанодисперсный, аморфный ГАП
Одними из основных отличий технологии получения биоактивного, аморфного, нанодисперсного гидроксиапатита кальция, входящего в состав материала БИАЛЬГИН®, являются отсутствие побочных продуктов и, как следствие, возможность включения полисахаридов в процессе синтеза, что позволяет получать высокочистые биоактивные материалы с повышенной биосовместимостью. Альгинат натрия в свою очередь является типичным полисахаридом, оказывающим стимулирующее действие на рост клеток растительного и животного происхождения.
В ходе экспериментально-морфологического исследования медико-биологических характеристик материала БИАЛЬГИН®, проведенного на кафедре общей патологии ЦНИИС, установлено что испытанный материал при его введении в костную рану в значительной мере способствует активизации репаративного остеогенеза в области травмы. В задачи исследования входило изучение воздействия материала на течение репаративного остеогенеза и его интенсивность.
Опыты ставили на 20 крысах, ♂, линии Вистар весом 200±2 г., у которых в диафизе бедренной кости воспроизводили стандартные дефекты диаметром и глубиной, соответственно, 1 и 0.5 мм. Дефекты покрывали миллипоровой пленкой, изолируя костную рану от периостального источника регенерации. Животных разделили на 2 группы, контрольную и основную. В контрольной группе костный дефект заживал под кровяным сгустком, в основной группе в костные дефекты инокулировали БИАЛЬГИН®. Животных выводили из опыта через 5 и 10 суток после экспериментальной операции. С помощью гистологического и морфометрического методов сравнивали процесс новообразования костных структур в экспериментально воспроизведенных дефектах кости в основной и контрольной группах опыта.
В качестве критериев для оценки темпов и интенсивности репаративного остеогенеза служили:
а). соотношение мягкотканного и костного компонентов регенерата;
б). степень дифференцировки костного вещеста и костных структур в целом.
Установлено, что в основной группе опыта, где в дефекты бедренной кости вводили БИАЛЬГИН®, происходила активизация репаративного остеогенеза и ускорялся процесс дифференциации новообразованной костной ткани, что выражалось прежде всего в резком повышении в основной группе опыта, по сравнению с контролем, удельного веса костной компоненты регенерата, а так же в более интенсивном созревании костного вещества. Учитывая то, что миллипоровая мембрана разъединяла периостальный и эндостальный источники регенерации, естественно сделать вывод о том, что механизм оптимизации регенераторного процесса в условиях эксперимента, проведенного по описанной методике, был связан с непосредственным активирующим воздействием материала на эндостальные элементы, являющиеся в данном случае преимущественным источником образования костного регенерата.
В основной группе животных через 5 суток после начала опытов в костных дефектах обнаруживались обширные территории активной регенерации. Ткань регенерата была представлена полями клеточноволокнистой остеогенной ткани, в которой определялись очаги активного новообразования тонких остеоидных и фиброзных костных балочек (рис. 3).
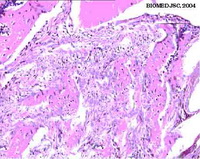
Рис.3. Микрофотограмма. Основная группа. Пять суток наблюдений. Участок регенерата в костном дефекте представленный клеточноволокнистой остеогенной тканью, характеризующейся активным новообразованием тонких остеоидных и фиброзных костных балочек. Х 200.
Через 10 суток от начала экспериментов костные дефекты в основной группе были полностью заполнены костным регенератом. Сетка из юных костных структур, продвигаясь вглубь канала трубчатой кости замещала красный костный мозг Края костного дефекта были спаяны с костным регенератом. Во всех случаях отмечалась интенсивная периостальная остеопластическая реакция. Периостальные напластования, располагающиеся несколько отступя от экспериментально воспроизведенных дефектов бедренной кости были мощными и занимали значительные территории сливаясь с эндостальной костной мозолью, что хорошо видно на рис. 4.
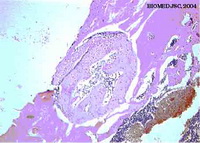
Рис. 4. Микрофотограмма. Основная группа. Десять суток наблюдений. Костный регенерат, имеющий вид незрелой губчатой формации полностью заполнил костный дефект. Между краями костного дефекта бедра костным регенератом имеется тонкая соединительнотканная прослойка. Над эндостальным регенератом, как бы отделенный от него тяжем клеточноволокнистой соединительной ткани, располагается периостальный костный регенерат. Х 100.
В контрольной группе через 5 суток от начала опыта при изучении серийных гистопрепаратов в образцах диафизов бедренной кости обнаруживались костные дефекты, проникающие в костный канал. При этом, наряду с кровоизлияниями и участками деструкции, обнаруживаемыми в красном костном мозге, в костном веществе краев костных дефектов можно было видеть обширные территории с развитием лизиса остеоцитов, сопровождающегося запустеванием костных лакун. Края костных фрагментов, составляющих стенки дефектов, были неровными, изъеденными с многочисленными глубокими лакунами в следствие выраженной резорбции. В просвете костных дефектов наблюдалось развитие клеточно-волокнистой соединительной ткани, местами с выраженным ангиоматозом и очагами интенсивной лейколимфомакрофагальной инфильтрации. Так же обращает на себя внимание почти полное отсутствие проявлений репаративного остеогенеза как в интермедиарной зоне, так и у краев перфорации кортикальных пластин (рис. 5). Лишь в области надкостницы у краев дефектов в этих наблюдениях было отмечено активное формирование регенераторных почек представленных сеточкой тонких остеоидных и фиброзных костных балочек.
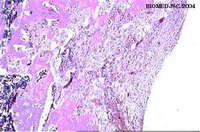
Рис. 5. Микрофотограмма. Контрольная группа. Пять суток наблюдений. Костный дефект заполнен клеточноволокнистой соединительной тканью. Костный компонент регенерата развит слабо. Края костного дефекта с множественными лакунами, изъедены. В нем отмечается широкая полоса безостеостной ткани. Х50.
Согласно данным проведенного исследования, БИАЛЬГИН® не оказывал сколько нибудь заметного токсического воздействия на ткани области экспериментального вмешательства и был рекомендован в качестве остеопластического материала, оптимизирующего регенерацию костной ткани в клинике общей и челюстно-лицевой хирургии, в хирургической стоматологии а так же в травматологии и ортопедии.
• Пародонтология: заполнение двух- или многостеночных костных карманов, а также би- и трифуркации зубов, аугментация атрофированной челюстной пазухи.
• Имплантология: синуслифт или поднятие синусового основания (субантральная аугментация), заполнение альвеолярных дефектов для поддержания челюстной пазухи после экстракции зуба, заполнение экстракционных дефектов с целью создания основы для импланта.
• Кистовые дефекты: дефекты после экстирпации костной кисты.
• Дефекты после резекции верхушки корня.
• Дефекты после удаления ретенированных зубов хирургическим путем.
• Прочие многосеточные костные дефекты альвеолярных отростков и лицевого черепа.
50 – 250 мкм - небольшие пародонтальные дефекты кости
250 – 500 мкм - более крупные пародонтальные дефекты кости
500 – 1000 мкм - средние и мелкие кистовые и альвеолярные дефекты
1000 – 2000, 2000-3000 мкм - крупные кистовые дефекты и синуслифт
Статья предоставлена "ЗАО БИОМЕД"